OSTALI SEMINARSKI RADOVI
IZ FIZIKE:
|
||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
Kraj klasične fizike
Naučno otkriće svojstva atoma dovelo je do potrebe za razvojem novih teorija o svjetlosti i materiji. U ovom poglavlju se govori o tome:- Kako su otkriveni elektroni i kako je izmjeren njihov naboj,
- Kako je otkriven nukleus i kako su identificirana njegova svojstva,
- Kako koristiti Rutherfordov model atoma,
- Kako atomi emituju i apsorbiraju svjetlo.
Njutnova mehanika, termodinamika, i Maxwellova teorija o elektromagnetima
čine neizostavni dio klasične fizike. Mnogi naučnici kasnih 1800 -tih
smatrali su da se sve može objasniti sa pomenutim teorijama, a neki su
smatrali da je već sve otkriveno. Oko 1900 –te proučavanja o strukturi
materije dovela su do mnogih iznenađujućih otkrića koja su bila nepoznata
klasičnoj fizici. Fizičari u ranom 20 –om stoljeću morali su preispitati
svoje osnovne pretpostavke o materiji i svjetlosti.
Ovo poglavlje ima dva cilja. Prvi je da otkrijemo kako su naučnici u 19
–om i ranom 20 –om stoljeću otkrili svojstva atoma. Drugi cilj je prepoznavanje
velikog broja novootkriveni svojstva atoma koja se nisu poklapala sa teorijama
klasične fizike. Prije nego što pređemo na kvantnu fiziku, važno je da
prepoznamo greške u klasičnoj fizici, razloge njenog neuspjeha i potrebu
za izmjenama teorija o svijetlosti i materiji.
1800 –te godine tri glavna domena istraživanja naučnika su bila:
- Materija,
- Elektricitet,
- Svjetlost.
Ideja da se materija sastoji od malih, nedjeljivi čestica seže do Leucippusa i njegovog učenika Democritusa, koji su se proslavili u drevnoj Grčkoj oko 440-420 godine p. n. e. Oni su ove čestice nazvali atomi, Grčki za nedjeljivo. Teorija atoma nije bila širom prihvaćena, zahvaljujući velikom nedostatku dokaza ali je sama ideja atoma uspjela da preživi srednji vijek. Ali, otprilike u vrijeme Newtona i u počecima mehaničke koncepcije svijeta interes za atome je oživio. Newton je istaknuo da je Boyleov zakon plinova – činjenica da pV ostaje nepromjenljiv za izotermni proces – moguće objasniti ako bi se plin sastojao od čestica. 1738 Daniel Bernoulli je unaprijedio ideju da se plinovi sastoje od malih oblika – atoma, čestica u neodređenom pokretu. Ipak, njegovi dokazi za postojanje atoma su još uvijek bili preslabi da bi njegova ideja bila išta više od slučajnosti. Stvari su se počele mijenjati u ranim godina 19. Stoljeća. Engleski hemičar John Dalton pokušao je dokazati da bi se hemijske reakcije mogle razumijeti kada bi se materija određenog hemijskog elementa sastojala od identičnih, neuništivih atoma. Dalton je također pokušao da uredi relativne mase atoma od različitih elemenata. Daltonove ideje proširio je Amedeo Avogadro , talijanski hemičar, koji je smatrao da sjedinjenjem više atoma formirale bi se kompleksnije, zasebne jedinice koje on naziva molekule, i da jednaka zapremina plinova, na jednakoj temperaturi sadrži jednak broj molekula. Polovinom 19. stoljeća razvojem termodinamike i kinetičke teorije plinova došlo se je do većeg broja dokaza o postojanju atoma. Postojanje atoma sa promjerom od otprilike 10-10 je bilo širom prihvaćeno do 1890.
 Elektricitet
Elektricitet
Električna struja je otkrivena oko 1800 –te godine i ovo otkriće je izazvalo
brojna pitanja o tome: da li je električnasupstancakonstantni
protok, ili se sastoji od zrnastih čestica elektriciteta. Za ovo nije
bilo konkretnog dokaza, ali protok struje je sugerirao na to da je struja
neka vrsta tečnosti.
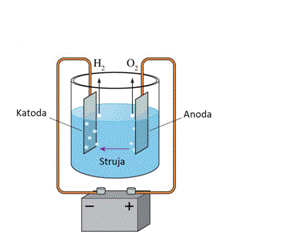
1800 –te Volta je izumio bateriju i odmah nakon toga je otkrio da se provodom
električne energije kroz vodu razlaže voda na vodik i kisik, i ovaj proces
je nazvan elektroliza.
Newton je bio zagovornik korpuskularne (čestične) teorije o svijetlosti
po kojoj male čestice svjetla putuju ravnom putanjom. Ova teorija je bila
dominantna u 18. stoljeću.
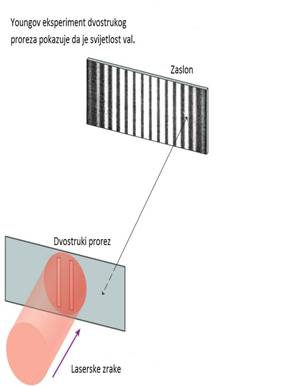
1801. engleski lingvista, fizičar i naučnik Thomas Young je prikazao interferenciju svijetlosti sa svojim čuvenim eksperimentom dvostrukog proreza.
1820. Michael Faraday, jedan od najznačajnijih naučnika u historiji proveo je istraživanja o materiji, elektricitetu i svijetlosti.
Faraday –ovo sistematsko i pažljivo mjerenje otkrilo je zakone elektrolize. Faraday je otkrio da postoje naboji povezani sa svakim atomom u otopini. Danas ti naboji su nazvani pozitivni i negativni joni. Faraday –ovo otkriće je upućivalo na to da:
- Atomi postoje
- Električni naboji su na neki način povezani sa atomima
- Postoje dvije vrste naboja, pozitivni i negativni
- Elektricitet je više u obliku čestica nego u obliku stalnog protoka.
Faraday je također proučavao da li električna energija može prolaziti
kroz zrak. Umetnuo je metalne elektrode u staklenu cijev, smanjio pritisak
sa vakumskom pumpom, nakon toga prikačio elektrostatički generator. Kad
je pokrenuo generator gas unutar cijevi je počeo da sjaji ljubičastom
bojom.
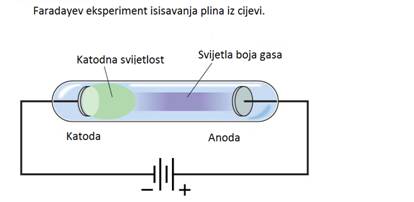
Faradayevo istraživanje je pokazalo da:
- Električna struja teče kroz gas niskog pritiska, stvarajući višak električne energije
- Boja viška energije zavisi od vrste gasa u cijevi
- Nebitno od vrste gasa, oko negativne elektrode (katode), postoji stalni sjaj nazvan katodna svijetlost
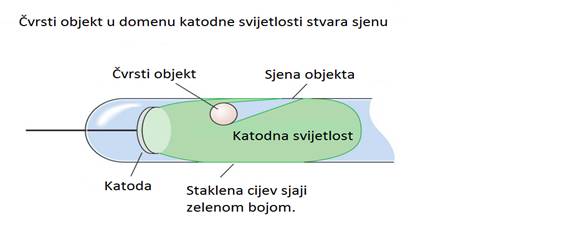
1850 -te naučnici su došli do otkrića da čvrsti objekt umetnut u Faradayevu
cijev stvara sjenu na zidu cijevi. Ovo otkriće dovodi do zaključka da
katoda emituje neku vrstu zraka koje putuju pravolinijski ali koje su
lako blokirane čvrstim objektom. Ove zrake su nazvane katodnim zrakama.
Crookesova cijev
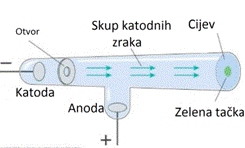 Crooke
je svojim radom došao do zaključka da:
Crooke
je svojim radom došao do zaključka da:
1. Postoji električna struja u cijevi kroz koju su emitovane katodne zrake
2. Magnetno polje usmjerava zrake kao da su negativnog naboja
3. Katode napravljene od bilo kojeg metala proizvode katodne zrake
4. Zrake vrše pritisak na objekt i mogu prenositi energiju na objekt.
Thomson je odredio brzinu kretanja katodnih zraka i omjer između naboja
i mase, odnosno specifični naboj. Za to je korištena posebna katodna cijev
u kojoj je omogućeno djelovanje električnog i magnetnog polja na katodne
zrake.
Dok nije uključeno magnetno polje, koje je inače položeno okomito na smjer
električnog polja, niti električno polje tada katodna zraka pada okomito
na fluorescentni zastor.
![]()
Ako se uključi magnetno polje poznate jakosti, zraka skrene razmjerno
gustoći magnetnog polja.
![]()
Ako se aktivira električno polje tako da ono upravo uravnoteži djelovanje
magnetnog polja zraka poprima svoj prvobitni okomiti smjer. U tom slučaju
sila pod utjecajem magnetnog polja i sila pod utjecajem električnog polja
jednake su, a to je prikazano na slici.
![]()
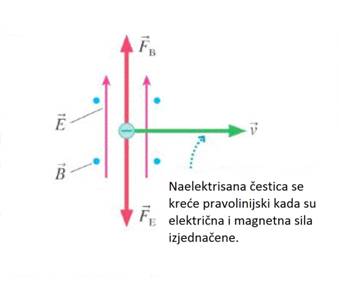
Izjednačavajući silu pod utjecajem električnog polja i silu pod utjecajem
magnetnog polja, Thomson je izračunao brzinu katodnih zraka
![]()
Izjednačavajući energiju koju u električnom polju dobije elektron sa kinetičkom
energijom elektrona, dobio je specifični naboj elektrona, odnosno omjer
njegovog naboja i mase:
![]()
i taj specifični naboj iznosi 1.76 x 1011C / kg.
Robert Andrews Millikan je napravio eksperiment s uljnim kapljicama,
kojim je odredio naboj elektrona. Ovaj eksperiment je prikazan na slici.
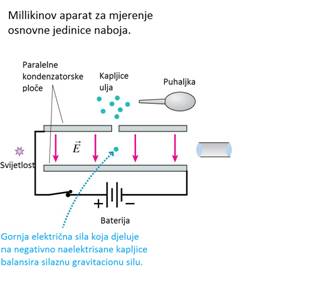
On je među paralelne kondenzatorske ploče puhaljkom raspršio nešto ulja
tako da nastanu sitne kapljice. Nakon toga je rendgenskim zrakama jonizirao
zrak između kondenzatorskih ploča. Nastali električno nabijeni elektroni
sakupili su se oko uljnih kapljica i nabili ih električnim nabojom. Kada
je na ploče kondenzatora stavljen napon, električki nabijene kapljice
ulja više se nisu kretale samo pod utjecajem sile teže, već i pod utjecajem
električnog polja.
Iz promjera i brzine kapljice te iz jačine električnog polja, Millikan
je izračunao da je električni naboj zapravo cjelobrojni umnožak od 1.6
x 10-19C, a to je zapravo naboj jednog elektrona.
Nakon te spoznaje, masa elektrona je jednostavno izračunata zahvaljujući
ranije određenom specifičnom naboju elektrona, te ona iznosi 9.11 x 10-31kg.
![]()
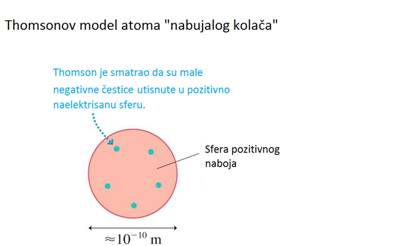
Prvi model atoma je statički model J. Thomsona. Budući da su mase atoma
puno veće od mase elektrona, Thomson je pretpostavio da je glavni dio
atomske mase pozitivan. I on smatra da je pozitivno naelektrisanje ravnomjerno
raspoređeno po sferi poluprečnika ≈10−10 m, a u koju su utisnuti negativni
elektroni. Ovaj model atoma je nazvan „puding sa šljivama”
ili „nabujali kolač“.
Rutherford je proučavajući zrake došao do otkrića da kristali urana emituju
najmanje dvije različite vrste zraka. Prve, koje je on nazvao alfa zrakama
lako je upijao i komad papira. Druge, beta zrake su mogle prodrijeti kroz
metal debljine 0.1 inča. Do 1906 –te on je izmjerio omjer naboja njihovih
masa.
![]()
mH – predstavlja masu atoma vodika. Ova vrijednost bi mogla predstavljati
zasebno joniziranu molekulu vodika H2+ (q = e, m = 2mH ), ili dvostruko
joniziran atom helijuma He++( q = 2e, m = 4 mH ).
Prvi eksperiment u nuklearnoj fizici
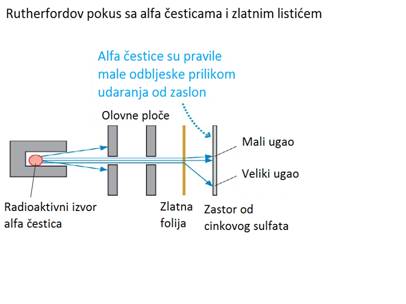
Eksperiment sa alfa-česticama i zlatnim listićem je bio jedan od najznačajnih
eksperimenata u nuklearnoj fizici. Ključni se pokus za to otkriće dogodio
1909. kada su znanstvenici vrlo tanki zlatni listić izložili djelovanju
alfa - čestica.
Thompsonov model atoma je predviđao da će alfa - čestice proći kroz tanki
metalni film i raspršiti se pod određenim malim uglovima. No, na veliko
je iznenađenje istraživačkog tima ustanovljeno raspršenje i pod velikim
uglovima, a neke su se helijeve jezgre od metalne folije odbile potpuno
unatrag. Oni su ispitivali raspršenje alfa - čestica na taj način što
su kroz mali otvor na olovnoj ploči, propuštali njihov uski snop, koji
je padao na tanki zlatni listić, debljine 0,01 mm. Iza zlatnog listića
je bio postavljen fluorescentni zastor od cinkovog sulfata, koji ima svojstva
scintilacije.
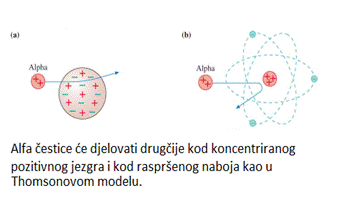 Figura
a pokazuje da je samo mali ugib očekivan od alfa čestica koje prolaze
kroz Thomsonov model atoma. Ali ako atom ima malo, pozitivno jezgro kao
sto je ovo na slici b, nekoliko alfa čestica mogu doći veoma
blizu jezgra atoma. Zbog toga što sila elektrona varira sa promjenom razdaljine
veoma velika sila koja djeluje na maloj udaljenosti od jezgra odbija se
pod velikim uglom. To su Greiger i Marsden posmatrali.
Figura
a pokazuje da je samo mali ugib očekivan od alfa čestica koje prolaze
kroz Thomsonov model atoma. Ali ako atom ima malo, pozitivno jezgro kao
sto je ovo na slici b, nekoliko alfa čestica mogu doći veoma
blizu jezgra atoma. Zbog toga što sila elektrona varira sa promjenom razdaljine
veoma velika sila koja djeluje na maloj udaljenosti od jezgra odbija se
pod velikim uglom. To su Greiger i Marsden posmatrali.
Elektron Volt
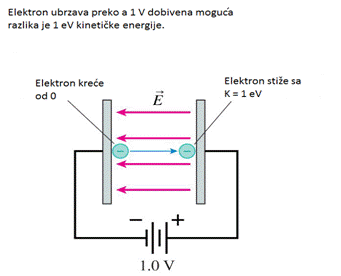 Slika
pokazuje ubrzanje elektrona (u vakumu), krećući od 0, između paralelnih
ploča kondenzatora, sa 1.0 V moguće razlike. Koja je elektronska kinetička
energija kada dostigne pozitivnu ploču? Već je poznato iz formula očuvanja
energije da je Kf + qVf = Ki + qVi gdje U = qV je električna potencijalna
energija. Ki = 0, zbog toga što elektron kreće od 0, i naboj elektrona
je q = -e
Slika
pokazuje ubrzanje elektrona (u vakumu), krećući od 0, između paralelnih
ploča kondenzatora, sa 1.0 V moguće razlike. Koja je elektronska kinetička
energija kada dostigne pozitivnu ploču? Već je poznato iz formula očuvanja
energije da je Kf + qVf = Ki + qVi gdje U = qV je električna potencijalna
energija. Ki = 0, zbog toga što elektron kreće od 0, i naboj elektrona
je q = -e
Iz toga zaključujemo:
![]()
Iz ovoga ćemo definirati novu jedinicu energije, nazvanu elektron volt
1elektron volt = 1 eV = 1.60 x 10-19 J
Korištenje modela jezgra
Model jezgra atoma najjednostavnije oslikava proces ionizacije. Elektroni
u svom kretanju mogu srušiti drugog elektrona sa orbite , stvarajući pozitivni
jon. Otklanjajući jedan elektron stvara se zasebno naelektrisan jon sa
q = +e. Otklanjajući dva elektrona stvara se dvostruko naelektrisan jon
sa q = +2e. Ovo je prikazano na sljedećoj slici. 
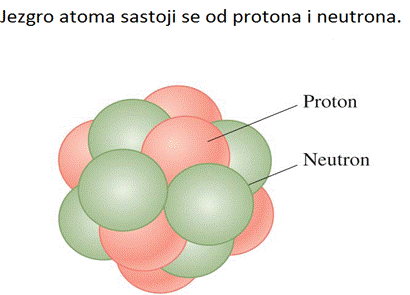
Atomski broj elementa opisuje broj protona u jezgru. Elementi u periodnom sistemu elemenata su poredani po svom atomskom broju. Ali šta znači kad kažemo da maseni broj Vodika je 1, Helijuma 2, Litijuma 3 itd.? Došlo se do saznanja da atomi vodika mogu biti samo zasebno jonizirani, proizvodeći H+ jone. Dvostruko joniziran H++ nikad nije bio proučavan. Za razliku od vodika Helijum može biti i zasebno i dvostruko joniziran stvarajući He+ i He++ jone, ali He+++ nikad nije bio proučavan. Nakon Thomsonovog otkrića elektrona i Millikanova otkrića osnovne jedinice naboja bilo je očigledno da atomi hidrogena sadrže samo 1 elektron i jednu jedinicu pozitivnog naboja, helijum ima 2 elektona i dvije jedinice pozitivnog naboja itd. Atomski broj je označen slovom Z, tako da je vodik Z = 1, helijum Z = 2 i litijum Z = 3. Atomi istog elementa koji imaju isti broj protona i elektrona, a različit broj neutrona nazivaju se izotopi. Broj neutrona se označava slovom N. Atomski maseni broj je definiran kao A = Z + N. To je cjelokupan broj protona i neutrona u jezgru.
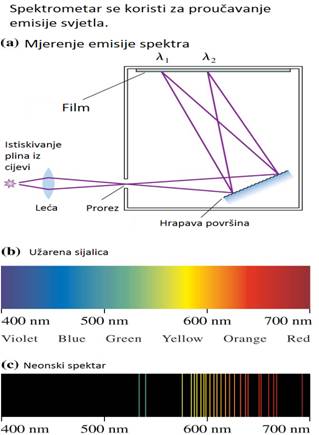 Dok
su naučnici proučavali strukturu materije, drugi su bili zauzeti proučavanjem
kako materija emituje i apsorbuje svjetlo. Izvor svjetlosti emituje talase
različitih valni dužina i ovo svjetlo je nazvano njegovim spektrom. Mjerenje
spektra je prikazano na slici (a).
Dok
su naučnici proučavali strukturu materije, drugi su bili zauzeti proučavanjem
kako materija emituje i apsorbuje svjetlo. Izvor svjetlosti emituje talase
različitih valni dužina i ovo svjetlo je nazvano njegovim spektrom. Mjerenje
spektra je prikazano na slici (a).
Vrući, samo -svjetleći objekti, kao što su Sunce, sijalica formiraju u
obliku duge, konstantni spektar u kojem je svjetlo emitovano na svakoj
mogućoj valnoj dužini to se može vidjeti iz priložene slike (b).
U suprotnosti, svjetlo emitovano istiskivanjem plina iz cijevi sadrži
samo određene, zasebne valne dužine. Takav spektar je nazvan diskretni
spektar. Svaka valna dužina u tom spektru je nazvana linija spektra, pa
se po tome i ovaj spektar često naziva linijski spektar. Ovaj spektar
je prikazan na slici (c).
Konstantni spektar i zračenje crnog tijela
Ohlađena lava je crna, ali zagrijana na visokoj temperaturi sjaji crveno
i ako je dovoljno zagrijana ima žutu boju. Volframova žica, tamno siva
na sobnoj temperaturi emituje bijelo svjetlo, kad je zagrijana. Ova temperatura
zavisi od emisije elektro -magnetni valova je nazvana termalna radijacija.
Toplotna energija Q zrači u vremenskom intervalu Δ t od strane objekta
sa površinom A i apsolutnom temperaturom T je izračunana formulom :
![]()
Q = 5.67 x 10-8 W/m2K4
Tok energije Φ je energija koju izrači površina tijela u poluprostor od
2π steradijana u jedinici vremena.
![]()
 Intenzitet zračenja I je energija koju izrači jedinica površine tijela
u poluprostor od 2π u jedinici vremena. Vrijednost e varira od 0 do 1.
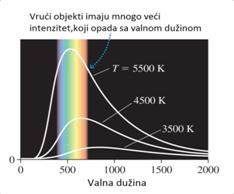
Idealno crno tijelo je tijelo koje apsorbira sve valne duljine upadnog
elektromagnetskog zračenja i ujedno s jednakom efikasnošću emitira sve
valne duljine. Ako izmjerimo spektar crnog tijela na temperaturama od
3500 K, 4500 K, i 5500 K dobićemo rezultat kao na slici.
Intenzitet zračenja I je energija koju izrači jedinica površine tijela
u poluprostor od 2π u jedinici vremena. Vrijednost e varira od 0 do 1.
Idealno crno tijelo je tijelo koje apsorbira sve valne duljine upadnog
elektromagnetskog zračenja i ujedno s jednakom efikasnošću emitira sve
valne duljine. Ako izmjerimo spektar crnog tijela na temperaturama od
3500 K, 4500 K, i 5500 K dobićemo rezultat kao na slici.
Linijski spektri
Atomi razrijeđenih plinova i para metala, pobuđeni električnom strujom
ili grijanjem, emitiraju svjetlost sastavljenu od valova određenih valnih
duljina. Kažemo da se spektar te svjetlosti sastoji od niza diskretnih
spektralnih linija.
Najjednostavniji spektar je linijski spektar vodika. Iako se spektar sastoji
od mnogo linija u infracrvenom, vidljivom i ultraljubičastom području,
one se ipak mogu grupirati u pojedine serije. Prvi je to uočio Johann
Balmer, pa se danas linije u vidljivom i ultraljubičastom dijelu spektra
zovu njegovim imenom.

Balmer je pokazao da se linijski spektar vodika može prikazati jednostavnom
formulom:
![]() , n = 3, 4, 5, ...
, n = 3, 4, 5, ...
Od samih početaka, čovjek je imao potrebu da istražuje i pokušava shvatiti pojave koje se događaju u svijetu oko njega. Razvoj klasične fizike seže još od antičkih vremena. Klasična fizika opisuje ponašanje i međudjelovanje tijela u makrosvijetu te je sve do 19. stoljeća bila temelj svih teorija. Međutim, kako su istraživanja kretala prema proučavanju sve manjih čestica, primjećivale su se pojave, koje se nisu mogle objasniti zakonima klasične fizike. Nemogućnost proučavanja takvih svojstava je u početku natjerala vodeće znanstvenike poput Thomsona, Faradaya, Bohra, Routherforda, i drugih da se bave proučavanjem kvantne fizike malih čestica. Sva ta istraživanja dovela su do novih saznanja koja su bila bitna za daljnju historiju čovječanstva.
19. stoljeće daje niz uspješnih fizikalnih teorija kao što su:
• Klasična termodinamika i statistička fizika (Maxwell, Boltzmann)
• Klasična teorija elektromagnetizma (Maxwell, Faraday, Hertz)
• Maxwell uključuje optiku u elektromagnetske pojave: svjetlost je val
koji se širi vakuumom
• 1898. Thomson: otkriće elektrona, prva elementarna čestica, te saznanje
da atom ima unutarnju građu.
preuzmi
seminarski rad u wordu » » »
